Rezumatul concluziilor
Simpozionului Anual de Studii Clinice 2020
Simpozionul Anual de Studii Clinice
desfășurat online pe 20 noiembrie 2020 a reunit
profesioniști internaționali și locali care au
împărtășit din experiența lor în dezvoltarea noilor terapii și vaccinuri, confruntată cu efectele pandemiei COVID-19 asupra dezvoltării studiilor
clinice, importantă etapă
din parcursul dezvoltării unei noi molecule care
stă la baza unui medicament, dar și
cea care oferă
multiple beneficii pacienților, medicilor și bugetului statului.
Tema ediției din 2020 a simpozionului a fost “2020 – UN AN AL PROVOCĂRILOR FĂRĂ PRECEDENT ÎN CERCETAREA CLINICĂ. Ce am învățat și cum putem transforma cele învățate în timpul pandemiei COVID-19 într-un avantaj pentru viitor?”.
“Simpozionul de Studii Clinice este unicul eveniment național cu participare internațională al comunității de specialiști în cercetare clinică din România, iar anul acesta și-a propus să creeze un cadru în care audiența să afle de la invitați de marcă despre modele de ultima oră pe care să le urmeze și despre obstacole pe care să le evite în față pandemiei COVID-19 și nu numai, acum și în viitor” a declarat Dr Cristina Florescu Moraid, președinte al Simpozionului Annual de Studii Clinice 2020 și CEO AVANTYO Institute of Clinical Research organizatorul simpozionului. “Această ediție este cea de a două organizată de AVANTYO Institute of Clinical Research sub patronajul EUCROF - Federația Europeană a Companiilor Conducătoare de Studii Clinice și ACCSCR - Asociația Companiilor Conducătoare de Studii Clinice din România.”
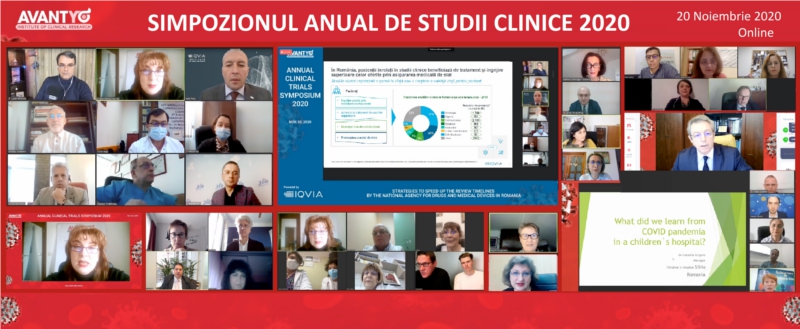
Impactul pandemiei COVID-19 asupra planificării și gestionării studiilor clinice, împreună cu învățămintele de considerat pentru viitor au fost discutate timp de o zi în cadrul a 6 sesiunilor interdisciplinare tip dezbatere și 2 prezentări , acestea fiind susținute de 42 de invitați în calitate de reprezentanți ai autorităților de reglementare din România și din alte țări europene, reprezentanți la nivel înalt ai industriei biofarmaceutice internaționale, specialiști în probleme de reglementare, KOL / investigatori medicali, reprezentanți ai CRO, asociații de pacienți. Invitații provin din din Bulgaria, Belgia,Franța, Germania, Liban, Polonia, Marea Britanie, România, Serbia, Slovakia, Ukraina, Ungaria. Aceștia și-au expus punctul de vedere în față unui public format din 123 profesioniști interesați de arena cercetării clinice.
Simpozionul a început cu subiectul fierbinte al reorganizării Agenției Naționale a Medicamentului și Dispozitivelor Medicale din România prevăzută de Legea 134/Aug2019, dar care nu este pusă în aplicare după mai mult de un an de la publicare. Dezbaterea a întrunit reprezentanți ai autorităților de reglementare, ai mediului academic, ai industriei farma (ARPIM) și ai companiilor conducătoare de studii clinice (ACCSCR). Discuțiile au pornit de la date concludente din raportul privind situația studiilor clinice realizat de IQVIA România la solicitarea ARPIM și ACCSCR și prezentat publicului în septembrie 2020. În lipsa unor răspunsuri clare și cuantificabile legate de pașii pe care ANMDMR, în calitate de autoritate de reglementare, îi va face pentru a scurtă perioada de aprobare a studiilor clinice ce depășește cu mult cele 60 de zile prevăzute în lege și în lipsa unui punct de vedere referitor la strategia adecvată din partea noii conduceri a agenției, concluzia a fost că este nevoie de mai multă transparență și comunicare din partea reprezentanților acestei față de pacienți, medici investigatori, companii conducătoare de studii clinice (CRO), reprezentanții sponsorilor (industria farmaceutica). Este demn de menționat că pentru rezolvarea status-quo-ului din agenție, toți ceilalți reprezentanți ai părților implicate în studii clinice – universitari, Comisia de Bioetică, sponsorii prin ARPIM și CRO-urile prin ACCSCR, și-au arătat disponibilitatea de a contribui, în limitele legii, la dezamorsarea situației.
Informații și statistici recente despre impactul epidemiologic al COVID-19 în România și Europa au fost aduse de Prof Dr. Adrian Streinu-Cercel, Director al Institutului de Boli Infecțioase “Prof. Dr. Matei Balș” din București, cu concluzii despre ce trebuie făcut pentru a nu fi forțați să intrăm din nou în lock-down chiar dacă ne aflăm deja în al doilea val al pandemiei. La nivelul a două mutații ale virusului pe lună, trebuie să fim pregătiți să testăm mai mult și să găsim soluții pentru a ne întoarce la viața noastră normală până când tratamentul va fi disponibil.
 Din dezbaterile despre impactul
pandemiei COVID-19 asupra comunității de
cercetare clinică, unde reprezentanții mediului academic și ai site-urilor
(centrele investigaționale – centre medicale și spitale) ne-au vorbit despre efectul asupra
activității lor din martie
până în prezent, am aflat că s-au confruntat cu multe
provocări deoarece multe studii au fost închise sau
amânate. În studiile oncologice, chiar și
pacienților negativi sau COVID asimptomatici, li
s-a limitat accesul la site acolo unde primesc
medicația de studiu și
sunt urmăriți.
Au existat o mulțime de întârzieri în ceea ce privește livrarea medicației de studiu către
pacienți și site. “Am aflat că în alte țări europene s-au folosit cu succes
serviciile “Direct-to-Patient” sau serviciile
“Home Care”, soluții
care sperăm să fie folosite și în România cât mai mult, fiind foarte bine adaptate pentru această perioada în care trebuie evitată
“expunerea” pacientiilor în spitale” a menționat Dr. Florescu.
Din dezbaterile despre impactul
pandemiei COVID-19 asupra comunității de
cercetare clinică, unde reprezentanții mediului academic și ai site-urilor
(centrele investigaționale – centre medicale și spitale) ne-au vorbit despre efectul asupra
activității lor din martie
până în prezent, am aflat că s-au confruntat cu multe
provocări deoarece multe studii au fost închise sau
amânate. În studiile oncologice, chiar și
pacienților negativi sau COVID asimptomatici, li
s-a limitat accesul la site acolo unde primesc
medicația de studiu și
sunt urmăriți.
Au existat o mulțime de întârzieri în ceea ce privește livrarea medicației de studiu către
pacienți și site. “Am aflat că în alte țări europene s-au folosit cu succes
serviciile “Direct-to-Patient” sau serviciile
“Home Care”, soluții
care sperăm să fie folosite și în România cât mai mult, fiind foarte bine adaptate pentru această perioada în care trebuie evitată
“expunerea” pacientiilor în spitale” a menționat Dr. Florescu.
Din discuția referitoare la implementarea Regulamentului European de Desfășurarea a Studiilor Clinice 536/2014 care va întra în vigoare în 2021 și din analiza statusului în toate țările europene prezente la această dezbatere - România, Ucraina, Slovacia, Moldova, Polonia - am aflat că acesta nu poate fi pus în aplicare fără implementarea corectă a CTIS, Sistemul Informatic pentru Studii Clinice dezvoltat de Agenția Europeană a Medicamentului - EMA.
Invitații la discuția despre alegerea site-urile de desfășurare a studiilor - reprezentanți ai unui CRO și a două mari firme farmaceutice internaționale - ne-au explicat că există o teamă adevărată și legitimă în toată lumea legat de vizita paciențillor la spital/site, că restricțiile provoacă întârzieri ale primei vizite a pacientului și că se confruntă cu provocări legate de monitorizarea siguranței pentru echipa de studiile clinice.
Rezultatul proiectul “PARADIGM - cadrul de guvernanță mulți-stakeholder pentru implicarea pacienților din Europa”, subliniază că pentru a crește accesul pacienților la cercetarea clinică înseamnă să fie găsit pacientul potrivit pentru studiul potrivit prin folosirea ghidului de practică elaborat de Paradigm și a instrumentelor oferite de acest proiect. De asemenea, atât pacienții cât și opinia publică au dreptul să afle într-o manieră mult mai transparentă care sunt rezultatele unui studiu clinic, cum se abordează un studiu clinic, care este patologia etc.
Despre înrolarea pacienților în studii clinice în timpul pandemiei COVID -19 s-a discutat în cadrul dezbaterii la care au fost invitați reprezentanți ai asociațiilor de pacienți. Chiar dacă, de exemplu, în Slovacia vestea bună este că recrutarea revine ușor la normal, există și alte țări precum țara noastră și Polonia în care deși au fost depuse eforturi în crearea de ghiduri pentru continuarea activităților, acestea nu au fost puse în aplicare chiar în condițiile în care s-a făcut lobby pentru continuarea înrolarii pacienților în studiile clinice. Soluția este implemetarea ghidurilor dând astfel pacienților posibilitatea de a fi recrutați și de a avea o șansă la medicație de ultima oră.
“Analizând cele spuse în mai multe sesiuni ale simpozionului, putem concluziona că trebuie folosite cele mai noi modalități de desfășurare a studiilor în mai mare siguranță, atât pentru pacienți cât și pentru echipe, iar noile tehnologii ne oferă această posibilitate. Ghidurile și protocoalele existente trebuie să fie puse în aplicare, iar legea să fie respectată. Ritmul de adaptare la noul Regulament European de Desfășurarea a Studiilor Clinice nr. 536/2014 care intră în vigoare în 2021 trebuie să fie mai accelerat, inclusiv la noi în țară” concluzionează Dr Cristina Florescu Moraid. “Referitor strict la România, unde există o comunitate de profesioniști foarte bine pregătiți, dacă țară noastră s-ar alinia la performanța celor mai eficiente țări, potențialul ar fi de 10-20 ori mai mare decât acum și am ajunge că piața noastră de studi clinice să depasesca 800 mil EUR. Putem spune că viitorul studiilor clinice depinde de felul în care ANMDMR își va transformă activitatea conform legii 134/Aug2019. Îmbunatirea activității agenției cu efect în reducerea perioadei de aprobare a studiilor clinice, înseamnă ca pacienții noștri să beneficiaze de tratament și îngrijire superioare celor oferite prin asigurarea medicală de stat, medicii să lucreze în proiecte de cercetare internațională cu descoperiri de ultima-oră, Casă Națională de Asigurări să fie degrevată de cheltuieli de sute de mii de euro anual iar la bugetul statului să se încaseze sume importante care ar putea ajunge la milioane de euro.”
Demersul de a reuni industria de studii clinice din România în jurul unor subiecte fierbinți prin Simpozionul Anual de Studii Clinice 2020, a fost realizat prin susținerea oferită de partenerii corporate ai evenimentului IQVIA Romania, Janssen Pharmaceutical Companies of Johnson&Johnson, Arensia Exploratory Medicine și PSI Pharma Support România. O contribuție importantă pentru diseminarea informațiilor a fost acordată de parteneri profesionali European Forum of GCP-EFGCP, InoMed, The Clinical Paediatrics Hospital of Sibiu, ROHEALTH – The Health and Bioeconomy Cluster, Camina Medical, ClinGroup și ClinAcademy. Evenimentul a fost promovat de către partenerii media: Medicalmanager, CASPA – Comunitatea Asociațiilor de Pacienți, Săptămâna Medicală, Medical Market, Viață Medicală, 360medical.ro, Medichub, RoMedic, Pacient 2.0 și Jurmed-Jurnal de sănătate.
Informații detaliate despre eveniment pe site-ul www.clinicaltrialsymposium.com.
Contexul studilori clinice în România
Reprezentanții industriei de studii clinice România, sunt preocupați de a readuce România pe harta internațională de interes pentru studii clinice cu beneficii reale de dezvoltare pentru medici, șanse la tratamente inovative pentru pacienți și sume importante la buget.
Deși este considerată o țară cu potențial, performanțele României în atragerea studiilor clinice înregistrează o tendință descendentă, numărul de studii scăzând drastic începând cu anul 2008. România (98 studii clinice) rămâne în urmă țărilor mai mici, precum Bulgaria (108) și Ungaria (207), că şi număr de studii clinice efectuate în 2019. Dacă numărul de studii clinice la un milion de oameni ar fi aliniat la nivel de țară cu cele mai performanțe țări din regiune, piața studiilor clinice din România, de doar 72 milioane EUR, ar putea avea potențialul de a atinge 802 milioane EUR și chiar 1,4 miliarde EUR prin comparație cu cele mai performanțe țări din UE.
România înregistrează un număr mic de studii clinice în derulare raportat la populație, Cu 163 de studii aprobate în 2019 și cu doar 10 studii la un milion de locuitori, ocupând penultimul loc în ierarhia europeană. Număr de studii clinice efectuate în 2019, situează România (98 studii clinice) în urmă țărilor vecine mai mici, Bulgaria (108) și Ungaria (207).
Sursa: Studii Clinice – Investiții Străine în România, Iulie 2020, Raport final -